在生產和生活中,矽膠可用於乾燥N2、空氣、氫氣、天然氣[1]等。根據酸鹼,乾燥劑可分為:酸性乾燥劑、鹼性乾燥劑和中性乾燥劑[2]。矽膠看似中性乾燥劑,似乎可以乾燥NH3、HCl、SO2等。但從原理來看,矽膠是由原矽酸分子三維分子間脫水而成,主體是SiO2,表面富含羥基(見圖1)。矽膠之所以能吸水,是因為矽膠表面的矽羥基能與水分子形成分子間氫鍵,因而能吸附水,進而起到乾燥作用。變色矽膠中含有鈷離子,吸附水達到飽和後,變色矽膠中的鈷離子變成水合鈷離子,進而使藍色矽膠變成粉紅色。將粉紅色矽膠在200℃加熱一段時間後,矽膠與水分子之間的氫鍵斷裂,變色的矽膠又會變成藍色,這樣矽酸與矽膠的結構圖就可以重複使用,如圖1所示。所以,由於矽膠表面富含羥基,矽膠表面也可能與NH3、HCl等形成分子間氫鍵,可能無法起到作用NH3和HCl的乾燥劑,現有文獻中未見相關報導。那麼結果如何呢?本課題做了以下實驗研究。
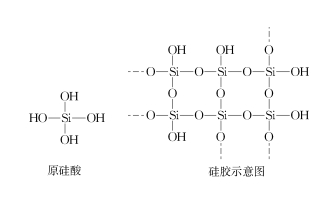
圖.圖1 原矽酸和矽膠結構圖
2 實驗部分
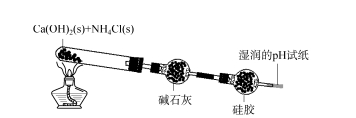
2.1 矽膠乾燥劑-氨的應用範圍探討首先將變色的矽膠分別放入蒸餾水和濃氨水中。變色的矽膠在蒸餾水中變成粉紅色;在濃氨水中,變色矽膠先變成紅色,慢慢變成淺藍色。這說明矽膠可以吸收氨中的NH3或NH3·H2O。如圖2所示,將固體氫氧化鈣和氯化銨在試管中均勻混合加熱。產生的氣體通過鹼石灰去除,然後通過矽膠去除。靠近入口方向的矽膠顏色變淺(探索圖2矽膠乾燥劑應用範圍的顏色-氨73,2023年第8期與浸泡後的矽膠顏色基本一致)濃氨水),pH試紙無明顯變化。這表示產生的NH3還沒有達到pH試紙的要求,已經被完全吸附了。一段時間後,停止加熱,取出一小部分矽膠球,放入蒸餾水中,向水中加入酚酞,溶液變成紅色,表示矽膠對水有較強的吸附作用。NH3,脫去蒸餾水後,NH3 進入蒸餾水中,溶液呈鹼性。因此,由於矽膠對NH3有較強的吸附作用,因此矽膠乾燥劑無法乾燥NH3。
2.2矽膠乾燥劑應用範圍探討-氯化氫先用酒精燈火焰燃燒NaCl固體,除去固體成分中的濕水。樣品冷卻後,在氯化鈉固體中加入濃硫酸,立即產生大量氣泡。產生的氣體通入裝有矽膠的球形乾燥管,乾燥管末端放置濕pH試紙。前端矽膠變成淺綠色,濕pH試紙無明顯變化(見圖3)。這表示產生的HCl氣體被矽膠完全吸附,沒有逸散到空氣中。
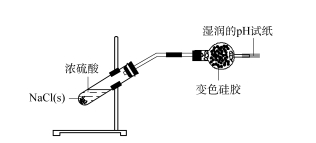
圖3 矽膠乾燥劑-氯化氫的應用範圍研究
將矽膠吸附HCl並變成淺綠色,置於試管中。將新的藍色矽膠放入試管中,加入濃鹽酸,矽膠也變成淺綠色,兩者顏色基本上相同。這顯示了球形乾燥管中的矽膠氣體。
2.3 矽膠乾燥劑應用範圍探索-二氧化硫 濃硫酸與硫代硫酸鈉固體混合(見圖4),NA2s2 O3 +H2 SO4 ==Na2 SO4 +SO2 ↑+S↓+H2 O;產生的氣體通過裝有變色矽膠的乾燥管,變色矽膠變成淺藍綠色,濕試紙末端的藍色石蕊試紙沒有明顯變化,表明產生的SO2氣體已被矽膠球完全吸附,無法逃脫。
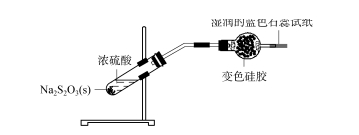
圖.4 矽膠乾燥劑-二氧化硫的應用範圍探討
取下一部分矽膠球,放入蒸餾水中。完全平衡後,取少量水滴在藍色石蕊試紙上。試紙沒有明顯變化,表示蒸餾水不足以從矽膠解吸SO2。取一小部分矽膠球,在試管中加熱。將濕藍色石蕊試紙放在試管口處。藍色石蕊試紙變成紅色,說明加熱使SO2氣體從矽膠球中脫附,使石蕊試紙變紅色。上述實驗表明,矽膠對SO2或H2SO3也有較強的吸附作用,不能用於乾燥SO2氣體。
2.4矽膠乾燥劑應用範圍探討-二氧化碳
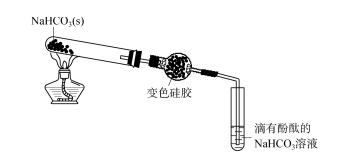
如圖5所示,滴加酚酞的碳酸氫鈉溶液呈現淺紅色。加熱碳酸氫鈉固體,並使所得氣體混合物通過含有乾燥矽膠球的乾燥管。矽膠沒有明顯變化,滴有酚酞的碳酸氫鈉吸附了HCl。變色矽膠中的鈷離子與Cl-形成綠色溶液並逐漸變為無色,顯示球形乾燥管末端存在CO2氣體複合物。將淺綠色的矽膠放入蒸餾水中,變色的矽膠逐漸變成黃色,表示矽膠吸附的HCl已解吸到水中。將少量上層水溶液加入硝酸酸化的硝酸銀溶液中,生成白色沉澱。將少量水溶液滴在寬範圍pH試紙上,試紙變紅色,表示溶液呈酸性。上述實驗顯示矽膠對HCl氣體有強烈的吸附作用。HCl是強極性分子,矽膠表面的羥基也具有較強的極性,兩者可能形成分子間氫鍵或產生較強的偶極偶極相互作用,導致矽膠表面之間產生較強的分子間作用力。凝膠和HCl分子,所以矽膠對HCl有很強的吸附作用。因此,矽膠乾燥劑不能用於乾燥HCl逸出,即矽膠不吸附CO2或僅部分吸附CO2。
圖.5 矽膠乾燥劑的應用範圍探討-二氧化碳
為了證明矽膠對二氧化碳氣體的吸附作用,繼續進行以下實驗。取出球形乾燥管內的矽膠球,將部分分成滴有酚酞的碳酸氫鈉溶液。將碳酸氫鈉溶液脫色。這表示矽膠吸附二氧化碳,溶於水後,二氧化碳解吸到碳酸氫鈉溶液中,使碳酸氫鈉溶液褪色。將矽膠球的剩餘部分在乾燥試管中加熱,將產生的氣體通入滴有酚酞的碳酸氫鈉溶液中。很快,碳酸氫鈉溶液由淺紅色變為無色。這也說明矽膠對於CO2氣體仍具有吸附能力。但矽膠對CO2的吸附力遠小於HCl、NH3和SO2,在圖5的實驗過程中只能部分吸附二氧化碳。矽膠能部分吸附CO2的原因很可能是矽膠與CO2形成分子間氫鍵Si — OH… O=C。由於CO2的中心碳原子為sp雜化,而矽膠中的矽原子為sp3雜化,因此線性CO2分子與矽膠表面配合不好,導致矽膠對二氧化碳的吸附力相對較差。小的。
3.四種氣體在水中的溶解度及矽膠表面吸附狀況的比較從以上實驗結果可以看出,矽膠對氨氣、氯化氫和二氧化硫有很強的吸附能力,但對二氧化碳的吸附力小(見表1 )。這與四種氣體在水中的溶解度相似。這可能是因為水分子含有羥基-OH,而矽膠表面也富含羥基,所以這四種氣體在水中的溶解度與其在矽膠表面的吸附非常相似。在氨氣、氯化氫和二氧化硫三種氣體中,二氧化硫在水中的溶解度最小,但被矽膠吸附後,卻是三種氣體中最難解吸的。矽膠吸附氨和氯化氫後,可用溶劑水解吸。二氧化硫氣體被矽膠吸附後,很難用水解吸,必須加熱才能從矽膠表面解吸。因此,四種氣體在矽膠表面的吸附量必須進行理論計算。
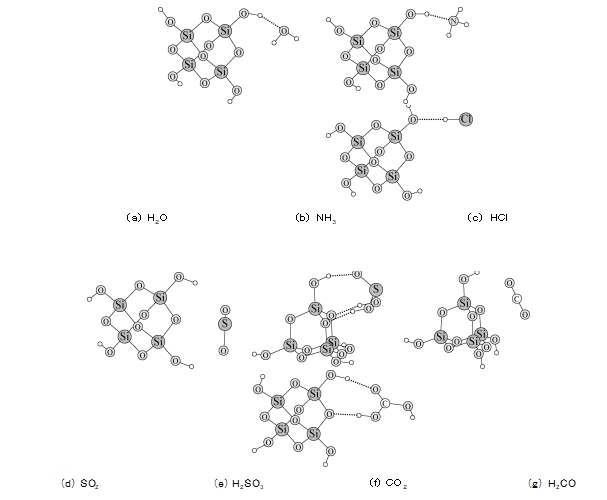
4 量子化ORCA 軟體[4]在密度泛函理論(DFT) 框架下對矽膠與四種氣體之間的相互作用進行了理論計算。利用DFT D/B3LYP/Def2 TZVP方法計算不同氣體與矽膠之間的相互作用模式與能量。為了簡化計算,矽膠固體以四聚原矽酸分子表示。計算結果表明,H2O、NH3和HCl均能與矽膠表面的羥基形成氫鍵(見圖6a~c)。它們在矽膠表面有較強的結合能(見表2),很容易吸附在矽膠表面。由於NH3和HCl的結合能與H2O相似,水洗可導致這兩種氣體分子解吸。對於SO2分子,其結合能僅為-17.47 kJ/mol,比上述三種分子小得多。但實驗證實,SO2氣體很容易吸附在矽膠上,即使洗滌也不能解吸,只有加熱才能使SO2從矽膠表面逸出。因此,我們猜測SO2很可能在矽膠表面與H2O結合形成H2SO3組分。圖6e顯示H2SO3分子同時與矽膠表面的羥基和氧原子形成三個氫鍵,結合能高達-76.63 kJ/mol,這解釋了為什麼SO2吸附在矽膠上矽膠上很難用水洗掉。非極性CO2與矽膠的結合能力最弱,只能被矽膠部分吸附。雖然H2 CO3與矽膠的結合能也達到-65.65 kJ/mol,但CO2轉化為H2 CO3的速率並不高,因此CO2的吸附率也降低。從以上數據可看出,氣體分子的極性並不是判斷其能否被矽膠吸附的唯一標準,而與矽膠表面形成的氫鍵才是其穩定吸附的主要原因。
矽膠的成分為SiO2·nH2O,矽膠龐大的表面積和表面豐富的羥基使得矽膠可以作為性能優異的無毒乾燥劑,在生產和生活中廣泛應用。本文從實驗與理論計算兩方面證實,矽膠可由分子間氫鍵吸附NH3、HCl、SO2、CO2等氣體,因此矽膠無法用於乾燥這些氣體。矽膠的成分為SiO2·nH2O,矽膠龐大的表面積和表面豐富的羥基使得矽膠可以作為性能優異的無毒乾燥劑,在生產和生活中廣泛應用。本文從實驗與理論計算兩方面證實,矽膠可由分子間氫鍵吸附NH3、HCl、SO2、CO2等氣體,因此矽膠無法用於乾燥這些氣體。
發佈時間:2023年11月14日